Bjornevik, K. et al. L’analyse longitudinale révèle une incidence élevée du virus d’Epstein – Barr associée à la sclérose en plaques. Science 375296–301 (2022).
Filippi, M. et al. Sclérose en plaques. Nuit. Rév. Haze. Amorces 443 (2018).
Google Scholar
Oksenberg, Jr, Baranzini, SE, SAWC, S. & Hauser, SL La génétique de la sclérose en plaques: SNP pour la pathogenèse. Nuit. Le gène prêtre. 9516–526 (2008).
Bray, PF, Bloomer, LC, Salmon, VC, Bagley, MH & Larsen, PD Epstein – Barr Virus Infection et synthèse des anticorps chez les patients atteints de sclérose en plaques. Arc. Neurol. 40406–408 (1983).
Leibowitz, U. et al. Examen épidémiologique de la sclérose en plaques en Israël. Ii Sclérose en plaques et niveau d’assainissement. J. Neurol. NeuroSurg. Psychiatrie 2960–68 (1966).
Angelini, DF et al. Rose CD8+ T -CELL-Respons sur les antigènes lytiques d’Epstein -Barr-Virus dans la phase active de la sclérose en plaques. PHOST PATHOG. 9E1003220 (2013).
Lünemann, JD et al. Fréquence accrue et spécificité étendue des cellules T spécifiques de l’antigène nucléaire EBV latent dans la sclérose en plaques. Cerveau 1291493–1506 (2006).
Google Scholar
Lanz, TV et al. Les cellules B étendues clonales dans la sclérose en plaques se lient à EBV EBNA1 et Glialcam. Nature 603321–327 (2022).
Bar-Or, A. et al. Rituximab en récupérant la sclérose en plaques de la distribution: un procès de phase I marqué ouvert de 72 semaines. Ann. Neurol. 63395–400 (2008).
Hauser, SL et al. Décharge des cellules B avec du rituximab dans le cas d’une sclérose en plaques relativement remise. N. Engl. J. Med. 358676–688 (2008).
Hauser, SL et al. Ocrélizumab versus interféron ß-1a en récupérant la sclérose en plaques. N. Engl. J. Med. 376221–234 (2017).
Rubtsova, K. et al. Les cellules B exprimant le facteur de transcription T-bet entraînent l’auto-immunité de type lupus. J. Clin. Investir. 1271392–1404 (2017).
Google Scholar
Punnanititinont, A. et al. L’activation de TLR7 des cellules B associées à l’âge intervient dans un modèle de souris de la maladie de tir primaire. J. Leukoc. Biol. 115497–510 (2024).
Google Scholar
Tsubaki, T. et al. Accumulation de plasmocytes exprimant le CXCR3 dans les régions de sublateur synoviales de la polyarthrite rhumatoïde précoce en relation avec la production de MIK / CXCL9 aux fibroblastes synoviaux. Clinquant Exp. Immunol. 141363–371 (2005).
Fox, Ri, Luppi, M., Kang, Hi & Pisa, P. Réactivation du virus d’Epstein – Barr dans le syndrome de Sjogren. Semin à ressort. Immunopathol. 13217-231 (1991).
James, oui et al. Le lupus érythémateux systémique chez l’adulte est associé à une exposition antérieure sur le virus d’Epstein – Barr. Refm d’arthrite. 441122–1126 (2001).
Alspaugh, MA, Jensen, FC, Rabin, H. & Tan, Em-Lymphocytes transformé par le virus d’Epstein -Barr. Induction de l’antigène nucléaire réactif avec l’anticorps par polyarthrite rhumatoïde. J. Exp. Avec. 1471018–1027 (1978).
Sorelle, Ed et al. Les transcriptions résolues dans le temps révèlent divers destins de cellules B dans la réponse précoce à l’infection par le virus d’Epstein-Barr. Rep. 40111286 (2022).
Mouat, Ic et al. L’infection gammaerpesvirus entraîne des cellules B associées à l’âge contre la pathogénicité dans l’EAE et la SEP. Sci. Adv. 8Eade6844 (2022).
Miller, G. & Lipman, M. Comparaison du rendement des virus infectieux à partir de clones de lignées lymphoblastoïdes humaines et similaires transformées par le virus d’Epstein – Barr. J. Exp. Avec. 1381398–1412 (1973).
Miller, G. & Lipman, M. Libération du virus infectieux d’Epstein -Barr par des leukocytes transformés. Proc. Natl Acad. Sci. USA 70190–194 (1973).
Zdimerova, H. et al. Le contrôle immunitaire amorti du virus d’Epstein-Barr chez les souris humanisés est associée au facteur de risque de sclérose en plaques HLA-DR15. EUR. J. Immunol. 5164–75 (2021).
Van Langelaar, J. et al. Induction des cellules B exprimant le B-BET à filtrage cérébral dans la sclérose en plaques. Ann. Neurol. 86264–278 (2019).
Google Scholar
Cellules Jain, RW & Yong, VW B dans la maladie du système nerveux central: diversité, emplacements et physiopathologie. Nuit. Le prêtre Immunol. 22513–524 (2022).
Sorelle, Ed et al. Une signature des cellules B atypiques associées à l’EBV dans le syndrome cliniquement isolée est impliquée dans la progression de la sclérose en plaques. Faire une pression sur Fondu (2024).
Fournier, B. et al. Héritage TNFSF9 -Déficience provoquant une large infection d’Epstein -Barr-Virus par EBV+ Tumeurs dans le muscle lisse. J. Exp. Avec. 219E20211682 (2022).
Baranzini, voir et al. B -CELL -REPERTORE -CUCHING ET EXPANSION CLONAL DANS LA SCLÉROSIE MOLATIQUE LESSIONS CERVEAL. J. Immunol. 1635133–5144 (1999).
Yang, X. et al. Le liquide-liquide-fasis La périrification de RBM33 facilite le vieillissement de l’hippocampe en induisant la sénescence microgliale en activant CDN1A. Int. J. Biol. Macromol. 310142986 (2025).
Evans, AK et al. L’effet de l’inhibition des noradrénergs sur la neuroinflammation et la physiopathologie dans les modèles de souris de la maladie d’Alzheimer. J. Neuroinflammation 21322 (2024).
Reali, C. et al. L’inflammation méningée riche en cellules B s’associe à une augmentation du patient de la moelle épinière dans la sclérose en plaques. Pathol du cerveau. 30779–793 (2020).
Choi, Sr et al. L’inflammation méningée joue un rôle dans la pathologie de la sclérose en plaques progressive primaire. Cerveau 1352925-2937 (2012).
Google Scholar
McHugh, D. et al. L’EBV rend les cellules B sensibles au VIH-1 chez des souris humanisées. Life Sci. Alliance 3E202000640 (2020).
Google Scholar
White, Re et al. La carence en EBNA3B EBV favorise la lymphomagenèse des cellules B chez les souris humanisées et se trouve dans les tumeurs humaines. J. Clin. Investir. 1221487–1502 (2012).
Münz, C. latence et la réplication lytique dans l’oncogenèse du virus d’Epstein Barr. Nuit. Le prêtre microbiol. 17691–700 (2019).
Google Scholar
Babcock, JG, Hochberg, D. & Thorley-Lawson, par le modèle d’expression pour les gènes latenus du virus d’Epstein-Barr in vivo dépend du stade de différenciation de la cellule B infectée. Immunité 13497–506 (2000).
Sorelle, Ed, Ed, Ed, Ed. Devant. Immunol. 131001145 (2022).
Hochberg, D. et al. Démonstration du lymphome de Burkitt Epstein -Barr-Virus -fenotype en divisant les cellules de mémoire infectées latentes in vivo. Proc. Natl Acad. Sci. USA 101239–244 (2004).
NOWAG, H. et al. Les protéines de macroautopphagie aident la production de virus d’Epstein Barr et sont incorporées dans les particules virales. Ebiomedicine 1116–125 (2014).
Google Scholar
Lünemann, JD et al. Les cellules T spécifiques d’EBNA1 de patients atteints de jonctions de sclérose en plaques répondent avec des antigènes de myéline et coproduisent IFN-Y et IL-2. J. Exp. Avec. 2051763–1773 (2008).
Google Scholar
Serafini, B., Rosicarelli, B., Veroni, C., Mazzola, Ga & Aloisi, F. Epstein-Barr-Virus CD8 S-Cellules C CD8 sélectivement le cerveau dans la sclérose en plaques et interagir localement avec les cellules infectées par le virus: CLE pour une méthode immunopathologique de virus. J. Virol. (2019).
Gottlieb, A., Pham, HPT, Saltarrelli, JG & Lindsey, JW étendues T-lymphocytes dans le liquide céphalorachidien chez les patients atteints de sclérose en plaques sont spécifiques aux cellules B infectées par le virus d’Epstein-Barr. Proc. Natl Acad. Sci. USA 121E2315857121 (2024).
Thomas et al. Dimensions d’immunité EBNA1 à réactive croisée A-cristalline B et est associée à la sclérose en plaques. Sci. Adv. 9EADG3032 (2023).
Tengvall, K. et al. L’imitation moléculaire entre l’anoctamine 2 et l’antigène nucléaire du virus du virus de l’Epstein – Barr est associée au risque de sclérose en plaques. Proc. Natl Acad. Sci. USA 11616955–16960 (2019).
Sahir, F., Mateo, JM, Steinhoff, M. & Siveen, KS Développement d’un panneau de couleur 43 pour la caractérisation de la défense des cellules T conventionnelles et non conventionnelles, des cellules B, des cellules NK, des monocytes, des cellules dendritiques et des cellules lymphoïdes congénitales en utilisant la cytométrie des flux spectraux. Cytométrie a (2020).
Puccio, S. et al. Crusty: une plate-forme Web polyvalente pour une analyse rapide et une visualisation des données de cytométrie en flux de haute dimension. Nuit. Commun. 145102 (2023).
Adhikary, D. et al. Immunodomination des antigènes de cyclus lytique dans le virus d’Epstein-Barr spécifique CD4+ Préparation des cellules T pour la thérapie. Plos un 2E583 (2007).
Google Scholar
Nucel, J. et al. Connexion entre les réponses d’IgG aux protéines nucléocapsides de l’alphacoronavirus et la gravité de Covid-19. Devant. Immunol. 13889836 (2022).
Google Scholar
Soude, SS et al. La plasticité épigénétique permet le commerce du SNC avec les lymphocytes B infectés par EBV. PHOST PATHOG. 17E1009618 (2021).
Oner, A. & Kobold, S. Transwell Migration Assay pour interroger la chimiotaxie des cellules de car-T humain. Protoc étoile. 3101708 (2022).
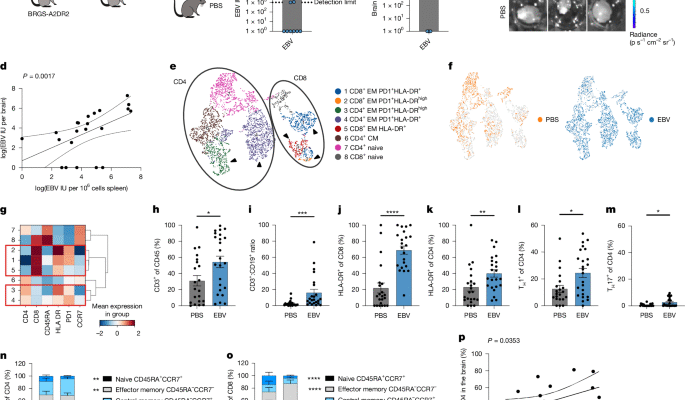
Fennell, E. Séquençage des récepteurs à cellule unique et b-cellules B des données traitées de la souris BRGS-A2DR2 infectée par EBV et PBS humanisée. Zenodo (2025).
Fennell, E. Images d’immunofluorescence multiplex de la rate à partir de souris BRGS-A2DR2 infectées par EBV. Zenodo (2025).